Сера и её соединения
| Сера | Соединения серы | |
| оксиды серы | серная кислота | |
1. При обычных условиях твёрдое жёлтое кристаллическое вещество. 2. Горит в кислороде:
3. Взаимодействует с металлами и водородом:
В природе:
|
1. При обычных условиях SO2 - газ, SO3 - твёрдое вещество. 2. Проявляют свойства кислотных оксидов, взаимодействуя с водой:
Получение:
|
1. При обычных условиях бесцветная тяжёлая жидкость (p ~ 2 г/см3), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: H2SO4 = H+ + HSO4 3. Взаимодействует с металлами: Zn + H2SO4 = ZnSO4 + H2 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами:
5. Взаимодействует с основными и амфотерными оксидами:
Получение в промышленности в соответствии со схемой: FeS2 (или S) |
| На главную
Выбрать элемент Короткопериодная ПС Гостевая книга |
© 2003-2005 WebElements Team |
По всем вопросам пишите на WebElements@narod.ru |
|
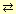 H2SO3
H2SO3
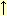 + H2O
+ H2O
 O2 SO2
O2 SO2